Úvod
Výživa kriticky chorých pacientov je neodmysliteľnou súčasťou liečby. V iniciálnej fáze stresového katabolizmu počas prvých dní hospitalizácie stačí hypokalorická výživa. Po stabilizácii klinického stavu treba čím skôr začať s enterálnou výživou (EV), pokiaľ pacient nemá relatívnu ani absolútnu kontraindikáciu, optimálne do 24 až 48 hodín.(1) Na konci prvého týždňa po preklenutí kritickej fázy katabolizmu treba zvýšiť výživu na denné odporúčané dávky energie a jednotlivých markronutrientov so zameraním sa na bielkoviny.(2,7) Väčšina našich pacientov netoleruje iniciálne enterálnu výživu z viacerých dôvodov – šokový stav, hypoxémia, hyperglykémia, analgosedácia, paralýza GIT-u atď., preto kombinujeme EV so suplementárnou parenterálnou výživou (PEV). Častým problémom v praxi býva oneskorený nástup nutričnej podpory, ktorý často nedosiahne denné odporúčané dávky.(3) V dohľadnom čase by mali byť aktualizované odporúčania na výživu kriticky chorých pacientov.
Kľúčové slová: optimalizácia výživy, gastrický reziduálny objem, ICUAW – intensive care unit aquired weakness syndróm
Kazuistika
V septembri 2017 bola na naše oddelenie prevezená 38-ročná pacientka s tumorom predného mediastína, so syndrómom hornej dutej žily (HDŽ), histologicky potvrdeným B-NHL.
Pacientka, doteraz bez komorbidít, bola začiatkom augusta 2017 hospitalizovaná v spádovej nemocnici pre rozvoj vírusovej perimyokarditídy s dobrým efektom na nesteroidné antiflogistiká. Pre opätovný rozvoj febrilít a dušnosť bola rehospitalizovaná koncom augusta 2017. CT angiografia vylúčila embolizáciu do artérie pulmonalis, realizovaná echokardiografia potvrdila extrakardiálny útlak ĽP, EF 60 %, prítomný perikardiálny výpotok. 31. 8. 2018 pacientka podstúpila fenestráciou perikardu s histologizáciou tumoru (histologicky potvrdený B-NHL). Pooperačne pre respiračnú insuficienciu pacientka ponechaná na UPV (umelej pľúcnej ventilácii). Pre rozvoj cirkulačnej instability nasadená vazopresorická podpora, pri febrilitách začatá empirická ATB terapia.
Dňa 6. 9. 2017 bola pacientka prevezená na naše pracovisko s cieľom podania chemoterapie (CHT) z vitálnej indikácie. Pacientka bola pri prijatí analgosedovaná, na UPV, FiO2 0,5, cirkulačne instabilná na noradrenalíne 300 ng/kg/min.
1. hospitalizačný deň bola realizovaná tracheostómia vzhľadom na očakávaný rozvoj pancytopénie po podaní CHT. Kontrolná echokardiografia potvrdila reziduálny perikardiálny výpotok, extramurálny útlak ĽP, EF 50 %, podľa bronchoskopie (BSC) prítomný extramurálny útlak bronchiálneho stromu bilaterálne. RTG hrudníka bez nálezu zápalových infiltrátov. Onkohematológ indikuje podanie chemoterapie.
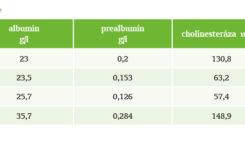
2. hospitalizačný deň pri detrahovanej vazopresorickej podpore sme začali EV v stimulačnej dávke 10 ml/hod. so suplementárnou parenterálnou výživou. Denný energetický príjem bol 22 kcal/kg/D, bielkoviny sme suplementovali v dávke 0,7 g/kg/D. Prvé týždne hospitalizácie bola pacientka živená prevažne parenterálne, a to aj napriek zavedenej nazojejunálnej sonde, keďže EV netolerovala ani pri plnej prokinetickej liečbe. Štandardnú enterálnu výživu sme vymenili za oligomérnu formulu. Keďže išlo o mladú pacientku s anamnézou krátkeho predchorobia, vstupné nutričné parametre boli na dolnej hranici normy (pozrite tabuľku).
Pre ultrasonograficky verifikovanú trombózu venae axillares, venae subclaviae a venae jugulares internae bilaterálne bola realizovaná výmena centrálneho venózneho katétra do véna femoralis, zvýšený LMWH na antikoagulačnú dávku. Pre intoleranciu EV a vysoký gastrický reziduálny objem (GRV) napriek plnej prokinetickej liečbe bola v tomto období pacientka živená prevažne parenterálnou cestou. Denný prísun energie bol 29 kcal/kg/D, cukry boli hradené v dávke 2,9 g/kg/D, tuky 1,35 g/kg/D a bielkoviny v dávke 1,49 g/kg/D. Nutričné parametre, ktoré stanovujeme 1-krát týždenne, boli uspokojivé. Prealbumín a transferín boli tesne pod dolnou hranicou normy.
23. hospitalizačný deň po zvládnutí septického šoku bola pacientke podaná 2. kúra CHT. Dochádza k očakávanému rozvoju pancytopénie. Napriek trombocytopénii pokračujeme v redukovanej dávke LMWH pre masívne edémy oboch horných končatín pri rozsiahlych trombózach. V tomto období sme zaznamenali pokles nutričných parametrov. Na kontrolnom CT vyšetrení hrudník + brucho + malá panva (H+B+MP) prítomná regresia tumoru, napriek tomu dochádza k progresii syndrómu HDŽ a nemožnosti odpojenia pacientky od UPV. Bola podaná 3. kúra chemoterapie (CHT).
46. deň hospitalizácie stav pacientky komplikovaný opätovne rozvojom septického šoku, pridružuje sa rozvoj akútnej renálnej insuficiencie kombinovanej genézy z prerenálnych a renálnych príčin v dôsledku septického šoku a toxicity amikacínu, kombinovaný s prechodnou poruchou sluchu. USG obličiek bez nálezu stázy v dutom systéme. Pri rozvoji anúrie nereagujúcej na konzervatívnu liečbu dochádza k vzniku paroxyzmu fibrilácie predsiení s rýchlou odpoveďou komôr, nasadená antiarytmická terapia amiodarónom, na ktorej dochádza k verzii na sínusový rytmus. Začatá intermitentná hemodialýza. V nasledujúcich dňoch dochádza k obnove diurézy, postupnej normalizácii dusíkatých látok.
Po zvládnutí septického šoku a akútnej renálnej insuficiencie pri dobrých ventilačných a oxygenačných parametroch pristupujeme opätovne k pokusu odpojenia pacientky od UPV, tzv. weaning. Pacientka toleruje EV v dávke 60 ml/hod. Zaznamenávame nárast nutričných parametrov. V rámci weaningu realizovaná punkcia fluidotoraxu vpravo pri normálnej hodnote trombocytov. Avšak u pacientky došlo o 4 dni k rozvoju trombocytopénie v dôsledku chemoterapie (CHT) a následnej anemizácii. Pre nález hemotoraxu vpravo zavedený hrudný drén. Kontrolné CT hrudníka potvrdilo ďalšiu regresiu tumoru.
77. deň hospitalizácie bola podaná 4. kúra CHT. Pre opakovaný rozvoj septického šoku aj v dôsledku opakovaných katétrových infekcií sme opäť zaznamenali pokles nutričných parametrov. Pre vzostup cholestatických enzýmov realizované USG abdómenu, bez známok cholelitiázy, intra- a extrahepatálnej cholestázy. Pokračujeme vo weaningu, pacientka intermitentne odpojená od UPV, napojená na umelý nos (UN). Popri EV cez nazojejunálnu sondu začatý sipping toleruje. Pacientka je v anabolickej fáze. Vzhľadom na rozvoj ťažkej myopatie kriticky chorých pacientov suplementujeme energiu a jednotlivé makronutrienty so zameraním sa na fortifikáciu bielkovín v maximálnej dennej odporúčanej dávke. Na zabudovanie bielkovín do svalov je kľúčová aj rehabilitácia, v našich podmienkach realizovaná 3× denne, z toho 1× denne príbuznými, ktorí navštevovali pacientku denne počas 120 dní hospitalizácie.
99. hospitalizačný deň bola pacientka dekanylovaná. Cca po 3 hodinách došlo k rozvoju dyspnoe v dôsledku retrakcie kože do tracheostómie, pacientka urgentne zaintubovaná, napojená na UPV. Realizovaná urgentná BSC bez patologického nálezu, následne urgentná retracheostómia. Nasledujúci deň bola pacientka dekanylovaná. Podstúpila 5. kúru CHT, plný p. o. príjem tolerovala, fortikovaný o nutridrinky. Po 120 dňoch bola pacientka preložená na onkohematologické oddelenie.
Následne pacientka absolvovala 2-týždenný pobyt na rehabilitačnom oddelení, začala znovu chodiť. Na základe kontrolného PET CT vyšetrenia z februára 2018 došlo u pacientky k relapsu ochorenia, preto v apríli 2018 podstúpila autológnu transplantáciu periférnych kmeňových buniek. Počas poslednej hospitalizácie prekonala pacientka opakované katétrové infekcie, s nálezom trombóz aj v oboch femorálnych žilách. Kontrolné PET CT z mája 2018 bolo bez patologického nálezu. Pacientka je takmer po 8 mesiacoch pobytu v nemocnici doma so svojou rodinou.
Záver
Oneskorené začatie nutričnej podpory u kriticky chorých pacientov vedie ku kumulatívnemu energetickému deficitu a potenciuje rozvoj ICUAW syndrómu. Trpí ním až 67 % ICU pacientov na UPV trvajúcej dlhšie ako 10 dní. Pri prepustení z nemocnice ním trpí asi 1/3 pacientov a prispieva k zvýšenej 1-ročnej mortalite. V prevencii a liečbe je kľúčová agresívna liečba sepsy, optimálna inzulinoterapia, pravidelné sedačné okno a optimalizácia výživy.(4) V praxi je EV často zbytočne prerušovaná pri nízkom GRV a neprítomnosti peristaltiky. Na jednotlivých pracoviskách je variabilita v stanovení akceptovateľného GRV, pričom význam GRV sa v poslednom období spochybňuje. Vysoký GRV súvisí skôr s vyšším rizikom zvracania ako s rozvojom aspiračnej pneumónie. Optimálne je zaviesť na každom pracovisku protokol merania GRV, čím by sa eliminovalo zbytočné prerušovanie EV a znížili by sme energetický deficit našich pacientov.(5, 6)
MUDr. Jana Haščičová
OAIM, Národný onkologický ústav, Bratislava
E-mail: jana.hascicova@nou.sk