Súhrn
Autori v článku opisujú priebeh diagnostiky a onkologickej liečby pacienta s karcinómom pažeráka, ktorý profitoval z nutričnej intervencie počas onkologickej liečby. V diskusii potom rozoberajú mechanizmy vzniku malnutrície u onkologických pacientov a význam nutričnej intervencie vo svetle medicíny založenej na dôkazoch.
Kľúčové slová: malnutrícia, kachexia, syndróm anorexia/kachexia, externá rádioterapia, sipping, nutričná intervencia
Úvod
Rôzne formy a stupne malnutrície sprevádzajú 40 až 80 % onkologických pacientov(1) a 85 % z nich trpí poklesom telesnej hmotnosti a nedostatočnou výživou počas onkologickej liečby.(2, 3) Chudnutie a malnutrícia majú za následok zníženie kvality života(4, 5, 6), vyššiu mieru komplikácií, hlavne v súvislosti s operačnou liečbou(7), menší benefit z onkologickej liečby a tiež jej vyššiu toxicitu(8).
Necielený hmotnostný úbytok je všeobecne, nielen v gastroenterológii, považovaný za tzv. alarmujúci príznak, ktorý vyžaduje komplexné diagnostické objasnenie vrátane endoskopických vyšetrení. Pokiaľ pacient stratil necielene 10 % pôvodnej hmotnosti v priebehu ostatných 6 mesiacov (respektíve nastala strata hmotnosti 5 % za 1 mesiac, u geriatrických pacientov sú to 3 % za 1 mesiac), vzniká už indikácia na nutričnú intervenciu (spravidla v réžii praktického lekára)(9), pokiaľ je prítomná aj hypoalbuminémia, nutričná intervencia je absolútne indikovaná(10, 11). Riziko rozvoja malnutrície a progresívneho hmotnostného úbytku u onkologických pacientov býva obligátne(12) a vyplýva z prirodzeného priebehu malígneho ochorenia ako takého (nádorová anorexia, nádorová kachexia, nechutenstvo, paraneoplastické poruchy motility, gastroparéza asociovaná s malignitou), ešte výraznejšie riziko potom predstavujú malignity gastrointestinálneho traktu (žalúdka, pankreasu a pečene) a nádory v lokalitách, kde významne alterujú pasáž tráviacou rúrou (obštrukcia, ileus a pseudoobštrukčné syndrómy) alebo obmedzujú perorálny príjem potravy (ORL nádory hlavy a krku, pažeráka). Typickým príkladom sú malignity pažeráka s dysfágiou ako dominantným klinickým symptómom. Typická pažeráková dysfágia pre tuhú stravu vo včasnejších štádiách ochorenia väčšinou nelimituje perorálny príjem tekutín, preto je tzv. sipping (popíjanie) ideálnym spôsobom realizácie enterálnej nutričnej podpory. Dôležité je včasné začatie nutričnej intervencie ako príprava na operačnú a onkologickú liečbu.(12, 14, 15)
Kazuistika
Ide o 59-ročného muža, ktorý bol referovaný na naše pracovisko v marci 2019 pre dysfágiu a progresívny hmotnostný úbytok. Z anamnézy: vredová choroba žalúdka, „polárna“ resekcia žalúdka s ezofagoantrostómiou (1992), abúzy: chronický nikotinizmus a syndróm závislosti od alkoholu, pre ktoré pacient podstúpil ústavnú protialkoholickú liečbu (PAL). Od operácie žalúdka mával stabilnú hmotnosť v rozmedzí 70 – 75 kg, od jesene 2018 však začal pomaly necielene chudnúť a začali sa objavovať dysfagické ťažkosti, ktoré pomaly progredovali. Jedlo musel zapíjať, mával pocit, že mu zostáva po prehltnutí v hrdle. Pri nástupe na PAL vážil 57 kg a meral 168 cm (Body Mass Index 20,2 kg/m2). Keďže pacient mal ešte zachovaný perorálny príjem a dysfagické ťažkosti boli v úvode minimálne, hmotnostný úbytok bol sprvu pripisovaný karencii živín pri abúze alkoholu. Pravidelné stravovanie spolu so zavedenou enterálnou nutričnou podporou (Nutridrink 1× – 2× denne ako prídavok k strave) viedlo k zvýšeniu hmotnosti pacienta na 61 kg. Dysfágia však progredovala, a preto bol pacient objednaný na endoskopické vyšetrenie.
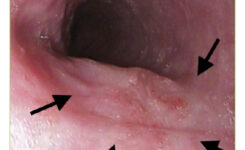
Ezofagogastroduodenoskopia (EGD) bola realizovaná po lokálnej anestézii orofaryngu (Lidocain spray) videoendoskopom Pentax EG-2990K s nálezom lokalizovanej prominencie s nerovnou sliznicou v proximálnom pažeráku 25 cm od predného zuboradia pri pomalej extrakcii prístroja (obrázok 1). Odobraté bioptické vzorky tejto ložiskovej, ale nepresne ohraničenej lézie veľkosti > 20 mm potvrdili infiltráciu stredne až nízko diferencovaným spinocelulárnym karcinómom.
CT vyšetrenie pažeráka infiltráciu nádorom potvrdilo, zobrazené minimálne zmeny steny pažeráka v dĺžke 27 mm, bez postihnutia regionálnych lymfatických uzlín. Pacient bol referovaný do spádovej nemocnice a odtiaľ odoslaný na konzultáciu k hrudnému chirurgovi a klinickému onkológovi v terciárnom nemocničnom zariadení. Vzhľadom na veľkosť, dignitu a staging neoplázie (T2N0M0) bola zvažovaná chirurgická liečba – ezofagektómia –, ktorá bola vyhodnotená hoci ako realizovateľná, ale vzhľadom na stav po operácii žalúdka technicky relatívne problematická, a preto bola po dohovore s pacientom indikovaná onkologická liečba – kombinovaná radikálna externá rádioterapia (ERT) s konkomitantnou chemoterapiou (CHT).
Onkologická liečba: august – október 2019, aplikovaná radikálna vysokokonformná ERT použitím Rapid arc techniky na oblasť pažeráka + regionálne lymfatické uzliny (v totálnej dávke TD: 45 Gy/1,8 Gy, následne RT boost v TD: 6 Gy/2 Gy do celkovej TD: 51 Gy) celkovo 6 týždňov každý pracovný deň, súčasne podané 2 cykly CHT cisplatina + fluorouracil v 1. a 4. týždni rádioterapie. Chemoterapia bola podávaná s cieľom potenciácie účinku rádioterapie. Počas onkologickej liečby sa u pacienta prejavili klinické príznaky radiačnej ezofagitídy a radiačnej tracheitídy, symptomatická liečba a enterálna nutričná podpora (Nutridrink 2× – 3× denne formou sippingu od prvých príznakov radiačnej ezofagitídy počas celého trvania onkologickej liečby a následne ešte 2 mesiace po jej ukončení) pomohli pacientovi ostať v stabilizovanom stave a bez potreby zavádzania výživovej sondy. Počas onkologickej liečby klesla jeho hmotnosť len o 3 kg a následne ešte počas liečby dosiahla 60 kg.
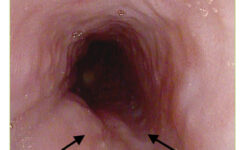
Kontrolná EGD bola realizovaná v rámci restagingu (Pentax EG-2990i s HD+ rozlíšením) v máji 2020 s nálezom výraznej regresie tumoru (obrázok 2) a s negatívnymi rebiopsiami. Aktuálne má pacient v réžii onkológa plánovaný restaging ochorenia s realizáciou PET/CT. Klinicky je pacient stabilizovaný, dysfagické ťažkosti výrazne ustúpili, požíva bežnú stravu a má stabilnú hmotnosť 61 kg.
Diskusia
Prezentovaná kazuistika predstavuje jeden z mnohých príkladov, ako jednoduchá nutričná intervencia pomáha prekonávať úskalia a komplikácie onkologickej liečby u pacienta s malignitou. Niet pochybností o tom, ako veľmi je dôležité u onkologických pacientov udržať primeraný stav výživy a zabrániť malnutrícii.(16) Včasná nutričná intervencia dokáže nielen zlepšiť stav ich výživy, ale zároveň im umožní lepšie tolerovať chirurgickú aj onkologickú liečbu.
Špecifiká malnutrície u onkologických pacientov
V odbornej literatúre je dobre dokumentované, že horšie výsledky onkologickej liečby majú pacienti s malnutríciou v porovnaní s pacientmi, ktorí sa nachádzajú v normálnom nutričnom stave.(17) V ére medicíny založenej na dôkazoch (Evidence Based Medicine – EBM) je potrebné nazerať na túto problematiku objektívne. Onkologickí pacienti predstavujú významne heterogénnu skupinu ľudí s rôznymi typmi nádorov, v rôznych štádiách ochorenia a s rôznou prognózou, ale s konkrétnymi ťažkosťami, príznakmi a komplikáciami. Preto je veľmi dôležité, aby sme k nim pristupovali individuálne a empaticky a zároveň indikovali nutričnú intervenciu v súlade s EBM hlavne v prípadoch, kde má objektívne význam a šancu na úspech.(18)
Malnutrícia je u niektorých onkologických pacientov spôsobená jednoducho neschopnosťou prijímať potravu vzhľadom na lokalizáciu základného nádorového ochorenia, u iných je príčinou tzv. syndróm anorexia/kachexia asociovaný s nádorovým ochorením (cancer-related anorexia/cachexia syndrome), kde nie je jednoduché dodávanie energie formou enterálnej nutričnej podpory odpoveďou na komplexnú etiológiu malnutrície.(20, 21) Práve pacienti s týmto syndrómom môžu tolerovať enterálnu nutričnú podporu horšie (vracanie, nechutenstvo, nadúvanie, hnačky) a potrebujú komplexnejší diagnosticko-terapeutický prístup.
Nutričná podpora počas onkologickej liečby
Počas onkologickej liečby sú obzvlášť zvýšené nároky na udržanie nutričného štandardu pacienta, na čo však často bežná strava nepostačuje.(22, 23) Časté sú limitácie na strane pacienta v súvislosti s jeho aktuálnym zdravotným stavom (komplikácie onkologickej liečby, nauzea a vracanie, nechutenstvo, gastroparéza, stomatitída, radiačná ezofagitída, dysfágia a odynofágia atď.). Objemovo limitovaný býva príjem tekutín u pacientov s komorbiditami (srdcovými, obličkovými, pľúcnymi). V týchto rozmanitých klinických situáciách je významným pomocníkom enterálna nutričná podpora so širokým spektrom klinicky testovaných a overených produktov, ktorých kombináciou môžeme dosiahnuť želaný nutričný efekt. Produkty enterálnej výživy sa líšia zložením i objemom a sú určené hlavne na tzv. sipping (popíjanie). U onkologických pacientov okrem štandardných produktov volíme často nutričné nápoje s imunomodulačnými vlastnosťami, nápoje s vlákninou sú vhodné pre pacientov trpiacich zápchou, nápoje s vysokým obsahom proteínov pri sarkopénii a tiež počas predoperačnej prípravy. Špeciálne nutričné produkty sú určené pre diabetikov alebo pre pacientov s dekubitmi. Pacienti, ktorí majú limitovaný príjem tekutín, môžu profitovať z popíjania vysokoenergetických nápojov bohatých na proteíny, živiny a vitamíny, koncentrované v menšom objeme.
Perioperačná nutričná podpora u onkologických pacientov
Vo všeobecnosti majú onkologickí pacienti podobné nutričné požiadavky ako ostatní chirurgickí pacienti, sú však náchylnejší na stratu hmotnosti a rozvoj malnutrície jednak kvôli samotnému základnému ochoreniu a jednak kvôli komplikáciám onkologickej liečby.(24, 25, 26, 27) Malnutrícia zvyšuje výskyt pooperačných infekcií, riziko tvorby dekubitov, zhoršuje hojenie rán, prispieva k bakteriálnemu prerastaniu v GITe. Predoperačná nutričná intervencia u podvyživených pacientov tieto komplikácie významne redukuje, a predstavuje tak neoddeliteľnú súčasť predoperačnej prípravy. V predoperačnom období sa odporúča intenzívna nutričná podpora u pacientov s evidentnou malnutríciou nápojmi s vysokým obsahom bielkovín (minimálne 5 – 7 dní) a tesne pred operáciou je vhodné použiť produkt s vysokým obsahom sacharidov.(28, 29, 30, 31, 32)
Záver
Enterálna nutričná podpora formou sippingu je najjednoduchším a veľmi efektívnym spôsobom realizácie nutričnej podpory u onkologických pacientov s malnutríciou, respektíve s vysokým rizikom jej rozvoja počas onkologickej liečby a v perioperačnom období. Nemala by sa však používať paušálne, indikácia nutričnej intervencie by mala nasledovať po dôkladnej analýze mechanizmov vzniku malnutrície u konkrétneho pacienta a po zhodnotení jej reálnych benefitov.
MUDr. Dušan Baláž
Gastroenterologická ambulancia, PIGEAS s.r.o., Martin
E-mail: dusan@pigeas.sk
MUDr. Martin Ďuríček, PhD.
Interná klinika gastroenterologická JLF UK, UNM, Martin
E-mail: dusan@pigeas.sk