Abstrakt
U pacientov po komplexnej kuratívnej liečbe nádorového ochorenia môže dôjsť k syndrómu krátkeho čreva po resekciách na gastrointestinálnom trakte. Do programu domácej parenterálnej výživy (DPV) v centre DPV v Národnom onkologickom ústave (NOÚ) sme od 1. 1. 2015 do 1. 6. 2018 zaradili 78 pacientov, z toho trinásti boli vyliečení z nádorového ochorenia. V našom článku sa v krátkom prehľade a dvoch kazuistikách chceme venovať práve tejto skupine pacientov s vyliečeným nádorovým ochorením, ktorí by bez adekvátnej nutričnej podpory zomreli. V prvej kazuistike rozoberáme práve prípad pacienta, ktorý dostal pri pomerne jednoduchých zákrokoch na gastrointestinálnom trakte nutričnú podporu neskoro, čo bolo príčinou jeho úmrtia. V druhej kazuistike sa venujeme našej prvej pacientke, ktorá je v programe DPV viac ako osem rokov.
Kľúčové slová: syndróm krátkeho čreva, malnutrícia, parenterálna výživa
Abstract
Among the patients undergoing complex anticancer treatment with curative intention short bowel syndrom can occure after gastrointestinal tract resections. Since establishing the Centre of home parenteral nutrition in National Oncology Institute in Bratislava 1.1.2015 till 1.6.2018 there were 78 patients accepted, 13 patients were cancer survivors. In a brief account in our article we have focused on these group of patients, which would withoud died parenteral nutrition support. In the first case report we are presenting history of patient, which were parenteral nutrition support given too late, and this was cause of his death. In the second case report we are presenting our first patient, wich is in home parenteral nutrition programm more than 8 years.
Key words: short bowel syndrom, malnutrition, parenteral nutrition
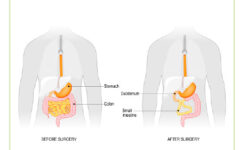
U pacientov po komplexnej kuratívnej liečbe nádorového ochorenia môže dôjsť k syndrómu krátkeho čreva po resekciách na gastrointestinálnom trakte. Tenké črevo má priemernú dĺžku asi 600 cm. Akákoľvek príčina, ktorá skráti dĺžku tenkého čreva pod 200 cm, vedie k strate viac ako 50 % absorbčnej plochy tenkého čreva a u pacienta sa vyvinie syndróm krátkeho čreva charakterizovaný neschopnosťou udržať vnútorné prostredie. Dochádza k dysbalancii príjmu a výdaja tekutín, elektrolytov, proteínov alebo mikronutrientov.(1) Tráviaci systém vyprodukuje denne 8 – 9 litrov tekutín, z toho sa 2/3 vstrebú v tenkom čreve a hrubé črevo je schopné absorbovať asi 5 litrov.(2) Resekcia väčšej časti tenkého čreva zneschopňuje tráviacu a absorbčnú funkciu čreva, čo vedie bez podpornej liečby k malnutrícii. Najčastejšou príčinou syndrómu krátkeho čreva býva Crohnova choroba a u onkologického pacienta postradiačná enteritída, následky po chirurgickej resekcii, pri malígnej črevnej obštrukcii alebo pri znížení absorbčnej plochy pri tenkočrevnej kolonizácii alebo pri malnutrícii.(1, 3)
Program DPV v NOÚ
Do programu domácej parenterálnej výživy (DPV) v centre DPV v Národnom onkologickom ústave sme od 1. 1. 2015 do 1. 6. 2018 zaradili 78 pacientov, z toho trinásti boli vyliečení z nádorového ochorenia. V našom článku sa v krátkom prehľade a dvoch kazuistikách chceme venovať práve tejto skupine pacientov s vyliečeným nádorovým ochorením, ktorí by bez adekvátnej nutričnej podpory zomreli. V prvej kazuistike rozoberáme práve prípad pacienta, ktorý dostal pri pomerne jednoduchých zákrokoch na gastrointestinálnom trakte nutričnú podporu neskoro, čo bolo príčinou jeho úmrtia. V druhej kazuistike sa venujeme našej prvej pacientke, ktorá je v programe DPV viac ako osem rokov.
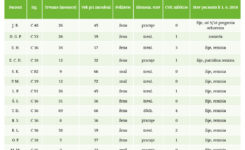
Pri syndróme krátkeho čreva je zabezpečenie výživy parenterálnou cestou kruciálnym momentom, ktorý má priamy vplyv na dĺžku života pacienta, ale aj na jeho kvalitu. V tabuľke č. 1 uvádzame prehľad o údajoch pacientov. Z trinástich pacientov sú štyria čiastočne ekonomicky aktívni, čo považujeme za dobrý znak kvality života. V súbore prevažujú ženy, z trinástich pacientov je desať žien. K 1. 6. 2018 jedna pacientka zomrela – pri progresii základného ochorenia. Jedna pacientka sprogredovala, teraz podstupuje biologickú liečbu, je stabilizovaná, bez nutnosti podávania parenterálnej výživy. Medián trvania podávania parenterálnej výživy je v našom súbore pacientov 26,6 mesiaca. Približne na 1 000 kaválových dní vychádza 1,5 infekcie CVK, čo je približný prepočet. Pri používaní taurolidínu sa podľa literatúry darí znížiť počet infekcií na 1 000 kaválových dní na 0,8.(4) Od marca 2015 používame taurolidín aj u našich pacientov v programe DPV.
V nasledujúcej kazuistike demonštrujeme, že ak výžive pacienta venujeme nedostatočnú pozornosť, môže to mať pre neho fatálne následky. Žiaľ, v určitých prípadoch začať živiť môže byť naozaj neskoro.
Kazuistika č. 1
69-ročnému pacientovi M. H. s anamnézou diabetes mellitus 2. typu, s chronickou obličkovou chorobou zrejme na podklade diabetickej nefropatie a s atrofiou pankreasu bol po mesačnom vyšetrovaní v novembri 2012 verifikovaný tumor v žalúdku a neskôr pri kolonoskopii aj tumor v oblasti hepatálnej flexúry. Histologicky bola v oboch prípadoch potvrdená malignita: v žalúdku išlo o invazívny adenokarcinóm, intestinálny typ, a v oblasti hepatálnej flexúry invazívny kolorektálny karcinóm. Pacient dostával tri mesiace neoadjuvantnú chemoterapiu 5-fluorouracilom s leukovorínom, ktorú ukončil v januári 2013. O mesiac, vo februári 2013, sa podrobil totálnej gastrektómii, D2 lymfadenektómii a pravostrannej hemikolektómii. Pre pozitivitu karcinómu v resekovaných lymfatických uzlinách bola indikovaná a realizovaná adjuvantná konkomitantná chemorádioterapia.
Približne po dvoch rokoch od ukončenia liečby, teda od februára 2015, sa pacient sťažoval, že nemôže jesť, za dva mesiace schudol 10 kg a mal bolesti pri prijímaní jedla. Nasledovala séria vyšetrení (CT vo februári 2015, gastrofibroskopia v marci 2015, PET-CT v apríli 2015), ktoré nepotvrdili predpokladanú recidívu základného ochorenia. V marci 2015 bol pri pasáži gastrointestinálnym traktom verifikovaný nepravidelne ohraničený kanál v anastomóze v dĺžke približne 1 cm, pričom kontrastná látka len sporadicky pasážovala do jejuna. Pri gastrofibroskopickom vyšetrení bola pod asi 30 cm pod anastomózou potvrdená stenóza jejuna. Pacienta v marci 2015 odporučil chirurg do paliatívnej ambulancie s cieľom zlepšenia nutrície a prípadného operačného riešenia. V laboratórnych parametroch neboli hodnoty kritické: cholínesteráza 98 μkat/l, prealbumín 0,112 g/l, transferín 1,530 g/l, CRP 40,6 mg/l, kreatinín 125 μmol/l, albumín 34,8 g/l, kálium 3,5 mmol/l, takzvané hepatálne parametre boli v norme. Klinicky bola však prítomná mykóza slizníc tráviaceho traktu – ústnej dutiny – a veľmi pravdepodobne aj tenkého čreva. Neskôr vyšlo najavo, že renálna insuficiencia bola klinicky významnejšia a vážnejšia než vypovedala hodnota kreatinínu. Klinicky bola prítomná trombóza žíl pravého predkolenia.
Po začatí podávania parenterálnej výživy dochádza k refraktérnym edémom na oboch dolných končatinách, nielen vpravo, kde bola prítomná trombóza. Začali sa zhoršovať pečeňové testy, dochádza k vzostupu gamaglutamyltransferázy, bolo nutné redukovať množstvo parenterálne podávaných substrátov. Tiež sa po vyššej bielkovinovej náloži zhoršujú aj renálne parametre pri preexistujúcom renálnom poškodení a dochádza k vzniku kaválovej infekcie, pričom v hemokultúre je zachytená E. coli. Pacientovi sa napriek liečbe rifaximínom zhoršujú hnačky, vylúčili sme infekciu Clostridium difficille. Parenterálnu výživu sme museli redukovať. Netoleroval vyššiu bielkovinovú nálož, zhoršujúce sa hepatálne parametre poukazovali na to, že pacient nebol schopný utilizovať substráty PV. Včasná enterálna výživa pomáha zachovať anabolizujúci pomer inzulínu a glukagónu, preto sme sa v danej situácii rozhodli pre vyvedenie nutričnej jejunostómie, ktorú však technicky nebolo možné realizovať, ako sme predpokladali pri plánovaní terapeutickej intervencie na začiatku.(6) Pacient zomrel za príznakov metabolického zlyhania, pričom neboli prítomné známky recidívy ani jedného karcinómu. Pacient skonal nie na onkologické ochorenie, ale na komplikácie, ktoré vyplývali z jeho liečby, a na to, že nutričná intervencia prišla do vyčerpaného organizmu, ktorý už nebol schopný anabolizmu, neskoro.
Pri analýze tejto situácie si musíme uvedomiť, že tu bolo viacero problémov:
• pri resekcii ileocekálnej chlopne a súčasne resekcii žalúdka sú vyradené oba bariérové systémy zabraňujúce nefyziologickej kolonizácii tenkého čreva baktériami a kvasinkami,
• chronický zápal tenkého čreva spôsobí malabsorbciu,
• premorbídne poškodenie obličiek sa opakovanými enterokolitídami zvýrazňuje.
Ileocekálna chlopňa spomaľuje pasáž tenkým črevom, čo umožňuje dlhší kontakt s absorbčnou plochou. Zabraňuje kolonizácii tenkého čreva baktériami a kvasinkami z hrubého čreva. Ak sa opakovane neriešia enteritídy pri nefyziologickej kolonizácii kvasinkami a baktériami z hrubého čreva, potenciované u daného pacienta aj resekciou žalúdka (je zrušená prirodzená baktericídna funkcia kyseliny chlorovodíkovej v žalúdku) a následnou rádioterapiou na oblasť epigastria s rozvojom postradiačnej enteritídy, v danom prípade nediagnostikovanej. Túto kazuistiku referujeme hlavne preto, aby sme si uvedomili, že niekedy je naozaj neskoro aj na začatie nutričnej podpory. Bez anticipácie problémov a pri nezabezpečení adaptačných mechanizomov tenkého čreva a prevencii prerenálneho zlyhávania dochádza k ireverzibilnému metabolickému vyčerpaniu, ktoré v danom klinickom prípade vyústili do smrti pacienta.
Adaptačné mechanizmy
Po strate absorpčnej plochy čreva nastupuje adaptácia – zotavovanie sa. Zahŕňa štrukturálne aj funkčné aspekty. Zvyšujú sa klky a prehlbujú sa krypty, nastávajú zmeny v luminálnych enzýmoch, normalizuje sa žalúdočná hypersekrácia a spomaľuje sa črevný transport.(5) Adaptácia tenkého čreva prebieha v troch fázach. Akútna fáza sa začína hneď po tenkočrevnej resekcii a trvá 1 – 3 mesiace. Výdaj z gastrointestinálneho traktu býva aj 5 l/deň. Pri tejto fáze hrozí dehydratácia a elektrolytová nerovnováha a je zhoršená absorbcia všetkých nutrientov. Začína byť prítomná hypergastrinémia a hyperbilirubinémia. Adaptačná fáza sa začína po 48 hodinách od resekcie a trvá 1 – 2 roky. Adaptačné mechanizmy majú najväčší potenciál rozvoja počas týchto dvoch rokov. Býva prítomná hyperplázia enterocytov, klkov, zväčšuje sa hĺbka krýpt a vstrebávacia plocha, nastáva tiež dilatácia a predlžovanie tenkého čreva. V tejto fáze je nevyhnutá enterálna výživa, s ktorou je nutné začať hneď, ako je to možné. Kľúčovú úlohu zohráva aj podávanie parenterálnej výživy. Počas udržiavacej fázy sa absorbčná schopnosť tenkého čreva zvýši na maximum. V tejto fáze je často možné parenterálnu výživu aj ukončiť, lebo nutričné požiadavky môžu byť zabezpečené len enterálnou formou, mnohokrát je však nutné celoživotné podávanie nutričných doplnkov.(1)
Parenterálna výživa a hydratácia je kľúčovým faktorom v terapii syndrómu krátkeho čreva. Jej podávanie predchádza vývoju ťažkej malnutrície a zlepšuje adaptačné mechanizmy hlavne v akútnej a adaptačnej fáze. Je dôležité kombinovať ju s podávaním enterálnej výživy. Včasným podaním parenterálnej výživy a podporou adaptačných mechanizmov môžeme u pacientov v ďalšom období predísť komplikáciám a dosiahnuť cieľ – urobiť ich nezávislými od parenterálnej výživy. Včasná enterálna výživa (pri syndróme krátkeho čreva a hnačkách sa odporúčajú oligomérne nutričné prípravky prípadne s glutamínom) pomáha zachovať anabolizujúci pomer inzulínu a glukagónu.(6) Adaptačné mechanizmy posilňuje kontinuálne podávanie enterálnej výživy hlavne v prvej fáze krátko po resekcii tenkého čreva.
Kazuistika č. 2
Druhá kazuistika má ešte stále otvorený koniec. Pacientka T. D., narodená v roku 1952, sa v auguste 2008 podrobila totálnej gastrektómii a D2 lymfadenektómii pre adenokarcinóm žalúdka. Do októbra 2008 dostávala zaisťovaciu chemorádioterapiu. Od februára 2009 bola viackrát laparotomovaná pre adhezívny ileus po postradiačnej enterokolitíde s nutnosťou viacnásobnej resekcie tenkého i hrubého čreva, nakoniec bola realizovaná ileoascendentoanastomóza a ascendentostómia. Pre nedostatočný perorálny príjem jej bola v júni 2010, keď mala pacientka 36 kg, nasadená doplnková parenterálna výživa. Prvá infekčná kaválová komplikácia nastala po 1,5 roku v decembri 2011. O ďalších 9 mesiacov, v septembri 2012, dochádza k druhej infekcii CVK a u pacientky sa rozvinula aspergilová pneumónia a MRI vyšetrením chrbtice realizovaným pre bolesti pacientky sme verifikovali spondylodiscitídu. Podľa MRI z februára 2013 pretrvávali kompresívne fraktúry tiel stavcov Th8 a Th9 so spotrebovaním platničky bez známok paravertebrálneho a epidurálneho abscesu. Koncom roka 2013 (november) zaznamenávame tretiu infekciu CVK, patogénmi sú Klebsiella pneumoniae a Eterobacter asburiae. V roku 2013 pacientka vážila 43 kg, mala ľahko znížené, ale stabilizované biochemické nutričné parametre. V januári 2014 dochádza k recidíve aspergilovej pneumónie, pričom v bronchoalveolárnej laváži boli zachytené aj ESBL kmeň E. coli a znovu Klebsiella pneumoniae, pacientka bola preliečená meropenémom a kaspofungínom. O osem mesiacov, v auguste 2014, dochádza k trombóze v. jugularis interna (VJI) bilat. so syndrómom hornej dutej žily. Pre záchyt S. Aureus, septický stav a dokumentovanú trombózu sme boli nútení exrahovať tunelizovaný CVK. V septembri 2014 sme dali pacientke zaviesť port do ľavej v. femoralis, ktorý sme v júli 2017 pre technické problémy (poškodenú membránu) vymenili za Hickmannov i. v. katéter do pravej v. femoralis. V novembri 2017 mala poslednú dokumentovanú infekciu – infekčnú artritídu pravého ramenného kĺbu so záchytom S. Aureus z hemokultúry „za studena“. Po cielenej antibiotickej liečbe je pacientka v stabilizovanom stave v ambulantnej starostlivosti. V júni 2018 vážila 51 kg. Pri opakovaných resekciách na tenkom čreve bola pacientke odstránená tiež ileocekálna chlopňa, vždy pri rozvoji enterokolitídy (meteorizmus, hnačky). Pacientku preliečujeme rifaximínom a po kultivačnom záchyte kvasiniek v stolici aj fluconazolom. Dochádza k tomu 2- až 3-krát ročne. Zabezpečujeme, aby bol zachovaný perorálny príjem pacientky v čo najväčšom rozsahu. Pacientka je v programe DPV ôsmy rok, mala štyri kaválové infekcie, dve vážne pneumónie, jedenkrát spondylodiscitídu a jedenkrát infekčnú artritídu.
Záver
Chceme zdôrazniť, aby bola realizovaná prevencia vzniku syndrómu krátkeho čreva u pacientov s vyliečeným nádorovým ochorením. Ak sa u pacientov po resekciách alebo po postradiačnej kolitíde bude venovať dôsledná pozornosť zachovaniu adaptačných mechanizmov, môžeme významne skrátiť nutnosť podávania PV v postresekčnom období. Nepríde k malnutrícii, ktorá vedie okrem iného k redukcii vstrebávacej plochy tenkého čreva. Ak sa zameriame na elimináciu opakovaných enterokolitíd napríklad pri resekcii ileocekálnej chlopne, tiež nemusí dôjsť k metabolickému vyčerpaniu organizmu pri protrahovaných zápaloch a tiež k redukcii vstrebávacej plochy.
Prim. MUDr. Andrea Škripeková, PhD.
Oddelenie klinickej onkológie F – Oddelenie paliatívnej medicíny, Centrum pre domácu parenterálnu výživu, NOÚ, Bratislava
E-mail: andrea.skripekova@nou.sk