Abstrakt
Metabolické zmeny vyvolané kritickou chorobou alebo úrazom zhŕňame pod pojem stresový metabolizmus. Typické je dominantné čerpanie energie z endogénnych zdrojov (rezerv) s výrazne zníženou schopnosťou utilizovať energiu z externých zdrojov. Rozhodujúcim zdrojom energie a glukózy pre kriticky dôležité tkanivá sú bielkoviny, predovšetkým svalové. Tzv. stresový autokanibalizmus vedie k veľkým stratám efektívnej svalovej hmoty, čo má zásadný význam pre prognózu rekonvalescenčnej fázy choroby. Nutrícia kriticky chorého pacienta teda vyžaduje nižší podiel celkovej energie (15 – 20 kcal/kg/deň) a vysoký podiel aminokyselín (1,5 – 2,5 g/kg/deň). Najefektívnejším prostriedkom na dosiahnutie takto koncipovanej výživy sú „all-in-one“ vaky pre parenterálnu výživu so zníženým obsahom celkovej energie a zvýšeným podielom dusíkatej energie.
Kľúčové slová: stresový metabolizmus, dusíková bilancia, stresový autokanibalizmus, „all-in-one“
Úvod
Súčasťou komplexnej reakcie organizmu na veľký stres sú aj rozsiahle zmeny metabolizmu. Pochopenie princípu týchto zmien dáva potom kľúč na pochopenie patofyziologických zmien u kriticky chorých pacientov a na stanovenie optimálnej nutričnej podpory ako integrálnej súčasti komplexnej intenzívnej starostlivosti.
Stresový metabolizmus
Metabolizmus kriticky chorého človeka – stresový metabolizmus – sa významne líši od metabolizmu zdravého človeka, ako aj pacienta v menej závažnom stave či pacienta po stabilizácii a prekonaní kritického stavu. Stresom v tomto kontexte rozumieme systémovú reakciu na ťažký, nadprahový inzult. Takýmto inzultom môže byť napríklad polytrauma, rozsiahla operácia, infekcia spojená s ťažkou systémovou reakciou (sepsa), ťažko alebo protrahovane prebiehajúci šok, popálenina, ale napríklad aj rozsiahly infarkt myokardu s kardiogénnym šokom a mnohé iné podnety. Je zrejmé, že závažnosť inzultu nie je jediný determinujúci faktor, do hry vstupujú faktory ako vek, kondícia a nutričný stav pacienta, ale aj genetické a epigenetické faktory, ktoré sú zatiaľ predmetom intenzívneho výskumu. Modelová dĺžka trvania stresového metabolizmu je sedem dní od inzultu, pričom prvé tri dni sa ešte vyhradzujú ako osobitná fáza. Opäť je zrejmé, že samotná dĺžka reakcie, podobne ako jej intenzita, je závislá od mnohých faktorov, okrem iného od dĺžky trvania a prípadných opakovaní prvotného impulzu, preto spomínaný interval musíme vnímať skôr orientačne.(1, 2)
Najlepšou analógiou na pochopenie stresového metabolizmu sú cirkulačné zmeny u kriticky chorého – centralizácia obehu a presmerovanie perfúzie ku kriticky potrebným orgánom a tkanivám. Analogicky, zmeny metabolizmu pri kritickej chorobe smerujú k metabolickému útlmu „nekritických“ tkanív (analogicky so zníženou oxygenáciou týchto tkanív, s ktorou priamo súvisia) a, naopak, presmerovaniu substrátov pre kriticky potrebné tkanivá. Druhou významnou zmenou pri stresovom metabolizme je obrat na využívanie endogénnych zdrojov energie a dusíka – zásob. Ide o veľmi starý, evolučne podmienený mechanizmus, ktorý možno prirovnať k situácii raneného zvieraťa: Je zrejmé, že ťažko poranený alebo inak chorý živočích nie je schopný sám získať potravu, preto o jeho prežití rozhoduje mobilizácia zásob na preklenutie kritického obdobia. Tento mechanizmus je v stresovej reakcii pevne zakotvený a jeho následkom je kriticky chorý človek schopný pokryť z externých zdrojov najviac 30 % energetických potrieb. Zvyšok sa pokrýva z rezerv.
Stresový autokanibalizmus, dusíková bilancia a prognóza
Kým zásoby glykogénu sú nízke a majú za úlohu vyrovnávať krátkodobé výkyvy glykémie súvisiace s príjmom potravy, tukové zásoby sú podstatne väčšie, avšak v stresovej situácii ťažko využiteľné. Práve zmeny v čisto energetickej, nebielkovinovej zložke metabolizmu sú dobre kvantifikovateľné závažnosťou stresovej inzulínovej rezistencie. Tá je pomerne dobre merateľná a ukazuje sa ako dobrý ukazovateľ závažnosti stresu. Zároveň ilustruje filozofiu stresovej metabolickej odpovede – šetrenie glukózy pre inzulín nezávislé tkanivá, teda kritické tkanivá závislé od glukózy, ktorej je pri zastavení externého príjmu predpoklad nedostatku. Jediným endogénnym, dlhodobo udržateľným zdrojom glukózy je v tejto situácii glukoneogenéza, teda syntéza glukózy predovšetkým z aminokyselín. A keďže nie je nič také ako zásobná bielkovina, hlavným zdrojom bielkovín sa stáva svalové tkanivo, čo vedie k fenoménu tzv. stresového autokanibalizmu.(3)
Jeden gram dusíka zodpovedá 6 gramom bielkovín, čo predstavuje 25 g svalovej hmoty. Negatívna dusíková bilancia u kritického pacienta môže dosahovať hodnotu desiatok gramov za deň, takže denná strata 30 g dusíka zodpovedá dennej strate až 750 g svalového tkaniva. Pri trvaní sedem dní môže ísť až o stratu blížiacu sa 5 kg aktívnej svalovej hmoty. Na dôvažok, strata svalovej hmoty nie je rovnomerne rozložená a dominantné straty sú na axiálnom svalstve, kam okrem iných patrí dýchacie svalstvo. Je zrejmé, že takáto rozsiahla strata svalovej hmoty sa musí prejaviť, a to predovšetkým vo fáze rekonvalescencie. K tomu sa pridávajú aj iné komplikácie súvisiace s proteínovou dysfunkciou – deficiencia humorálnej imunity, spomalenie reparačných mechanizmov a iné. Preto sa ukazuje, že kumulatívna negatívna dusíková bilancia počas kritickej fázy choroby, prakticky vzaté z obdobia pobytu na jednotke intenzívnej starostlivosti, je jedným z rozhodujúcich faktorov prognózy pacienta v rekonvalescenčnej fáze. Nemá zásadný vplyv na samotné prežitie kritickej fázy, ale na rýchlosť a efektívnosť rekonvalescencie a na vznik špecifických komplikácií, ako je imobilizačný syndróm s tvorbou dekubitov, imunodeficit a z neho vyplývajúce riziko nozokomiálnych infekcií a podobne.(4, 5, 6)
Výsledná funkčná kapacita organizmu po prekonaní akútnej fázy je teda daná jednak funkčnou rezervou na začiatku kritickej choroby, jednak amplitúdou a dĺžkou trvania stresového metabolizmu. Proteonutričnú rezervu pacienta je možné zvýšiť včasnou nutričnou intervenciou a prehabilitáciou vo fáze plánovania napríklad rozsiahleho výkonu. Toto je optimálny prístup, bohužiaľ, je nepoužiteľný u pacientov s akútnou chorobou či úrazom, kde musíme počítať s rezervou, akú organizmus mal pri samotnom prvotnom inzulte. Závažnosť stresovej reakcie možno nepochybne ovplyvniť včasnou a správnou kontrolou príčiny a intenzívnou starostlivosťou, avšak aj to má svoje limity. Poslednou možnosťou preto zostáva snaha o „damage control“, teda o minimalizáciu strát efektívnou nutričnou intervenciou.(7, 8)
Nutričná intervencia: málo energie, veľa dusíka
Vieme, že stresový metabolizmus je charakterizovaný nízkou potrebou externej energie a orientáciou na endogénne zdroje, predovšetkým svalové proteíny. Nutričná intervencia teda musí smerovať ku kontrolovanému prísunu energie a zároveň k redukcii negatívnej dusíkovej bilancie ako ťažiskového prognostického faktora. To vedie ku konceptu nízkoenergetickej a zároveň vysokoproteínovej výživy.(2, 6, 8, 9, 10)
Optimálnym prístupom je „goal directed“ výživa riadená nepriamou kalorimetriou, avšak v praxi sme často nútení použiť skôr orientačné výpočty.(11) Klasické odporúčanie ESPEN hovorí o energetickom príjme 20 – 25 kcal/kg/deň s podielom dusíkatej energie 20 %, čo zodpovedá príjmu bielkovín cca 1,2 g/kg/deň (odporučenie 1,2 – 1,5 g/kg/deň).(12, 13) Koncept nízkoenergetickej výživy hovorí o energetickom príjme 15 kcal/kg/deň a príjme bielkovín 1,5 – 2 g/kg/deň, podľa niektorých až 2,5 g/kg/deň, čím sa dostávame k podielu dusíkatej energie presahujúcemu 50 %. (2, 6, 8, 9, 10) V porovnávacích štúdiách sa nízkoenergetický koncept ukázal ako bezpečný, s nižším výskytom metabolických komplikácií, predovšetkým stresovej hyperglykémie. Takisto vysoký podiel dusíkatej energie sa ukazuje ako efektívny v redukcii negatívnej dusíkovej bilancie, ako aj v zlepšení prognózy rekonvalescenčnej fázy. Vysvetľuje sa to prednostnou utilizáciou externých aminokyselín pre glukoneogenézu, čím sa znižuje miera autokanibalizmu.(2, 4, 14)
Ak sú nutričné požiadavky kritického pacienta vo fáze stresového metabolizmu zreteľne odlišné, musia byť aj iné nároky na prostriedky nutričnej substitúcie. K vyššie uvedeným metabolickým zmenám musíme prirátať aj viac či menej vyjadrenú dysfunkciu GIT ako súčasť syndrómu mnohoorgánovej dysfunkcie. Možnosti efektívnej enterálnej výživy sú preto vo veľkej časti pacientov limitované na nízkoobjemovú, tzv. trofickú výživu, ktorej účelom nie je ani tak proteoenergetická substitúcia, ako predovšetkým lokálny trofický efekt na sliznicu GIT so všetkými jeho pozitívnymi účinkami.(12) Touto cestou je však nemožné dosiahnuť vyššie spomenutý nutričný cieľ, a to ani pri nízkoenergetickej koncepcii. Dominantnú úlohu v tejto fáze u kriticky chorých pacientov bude preto zohrávať parenterálna výživa s postupným prechodom na vysokoproteínové enterálne formuly.(15, 16, 17)
Parenterálna výživa systémom „all-in-one“
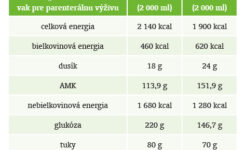
Najpresnejší spôsob, ako vystihnúť aktuálne nutričné potreby pacienta, je nepochybne systém „multiple bottle“. Ten je však náročnejší na erudíciu lekára, ale predovšetkým na ošetrovateľskú starostlivosť, spotrebu materiálu, prístrojové zabezpečenie a monitoring, ako aj na mikrobiologickú bezpečnosť. Z praktického hľadiska je pre potreby väčšiny pracovísk systém „all-in-one“ oveľa výhodnejší. Veľkým nedostatkom doteraz používaných prípravkov bolo ich zloženie, ktoré je svojím zložením vhodnejšie pre pacientov v rekonvalescenčnej fáze, prípadne až pre domácu parenterálnu výživu a podobne. Tradičné, u nás dostupné vaky zložením zodpovedajú príjmu energie približne 20 kcal/kg/deň s príjmom bielkovín 1,2 – 1,25 g/kg/deň, čo zodpovedá podielu dusíkatej energie cca 20 %. Výživu je možné doplniť separátne aminokyselinami, potom sa však už stráca výhoda systému „all-in-one“.
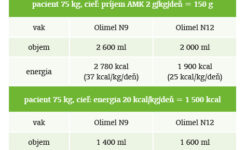
Preto sú v súčasnosti do praxe zavádzané „all-in-one“ vaky so zložením modifikovaným práve pre potreby pacientov so stresovým metabolizmom. Sú charakterizované zvýšeným obsahom aminokyselín pri celkovo zníženom energetickom obsahu. Toto zloženie umožňuje jednoduchým spôsobom priblížiť sa nízkoenergetickej, vysokoproteínovej koncepcii. Pri rovnakom použití ako pri štandardných vakoch dosiahneme príjem energie približne na úrovni 20 – 25 kcal/kg/deň pri bielkovinovom príjme v rozsahu 1,5 – 2 g/kg/deň, s podielom dusíkatej energie cca 30 %. Úpravou dávkovania máme možnosť prispôsobiť proteoenergetický príjem aktuálnym potrebám pacienta spôsobom, ktorý by pri použití štandardného vaku nebol možný. To dáva väčší manévrovací priestor a flexibilitu, ktorá bola doteraz možná iba systémom „multiple bottle“.
Záver
Výživa zostáva imperatívnou súčasťou liečby na jednotkách intenzívnej starostlivosti. Výsledok správnej, ale aj následok nesprávnej, nedostatočnej nutričnej podpory sa významným spôsobom premieta do výsledku, dĺžky a celého priebehu následnej hospitalizácie na štandardnom oddelení. Rešpektovanie princípu stresového metabolizmu u kriticky chorých pacientov a tomu zodpovedajúca voľba nutričnej podpory je jednoduchá a účinná intervencia, ktorá vedie k zlepšeniu prognózy širokého spektra kriticky chorých pacientov.
MUDr. Michal Gergel, PhD.
Chirurgická klinika UNB a LF SZU, Bratislava
E-mail: michal.gergel@kr.unb.sk