Proteiny a jejich základní stavební komponenty – aminokyseliny – mají několik životně důležitých funkcí:
a) Zajišťují strukturu a funkci tkání jak z hlediska podpůrných struktur, tak enzymů a mediátorových působků.
b) Část aminokyselin funguje jako důležité modulátory ve tkáních, bílkoviny a polypeptidy jsou důležitými složkami v imunitních reakcích, jsou substráty přenášejícími a uchovávajícími informace a zajišťují i koordinaci mezi orgánovými funkcemi.
c) Jsou rozsáhlým a spolehlivým zdrojem energie, aminokyseliny, zejména některé z nich, např. rozvětvené aminokyseliny valin, leucin, izoleucin, jsou při stresovém hladovění dostupným zdrojem energie i v situaci, kdy získávání energie z cukrů a tuků je významně omezeno, nebo prakticky zablokováno.
Vzhledem k těmto zásadním strukturálním a funkčním úlohám jsou vytvořeny složité mechanismy, které chrání proteiny, protože ztráta více než 25-30 % tělesných bílkovin způsobuje tak hluboké funkční poruchy v reakcích zabezpečovaných proteiny, které vyústí ve smrt. Udržení proteinových zásob je tedy základním cílem nutriční podpory, zejména u pacientů v kritickém stavu.
Tělesné bílkoviny jsou složeny z 20 různých aminokyselin, které se liší různým postavením v metabolismu. Přestože živý organismus obsahuje mnohonásobně větší množství sloučenin s aminoskupinou, pouze zmíněných 20 aminokyselin je kódováno geneticky a rozpoznáváno v rámci přenosu informací mezi DNA a RNA. Úvodní dělení aminokyselin na postradatelné, nepostradatelné (esenciální) a asistující se dnes již v tomto smyslu nepoužívá, protože hlubší poznání metabolismu aminokyselin v chorobných stavech nebo při maximální zátěži organismu vedlo ke zjištění, že každá postradatelná aminokyselina, která je i v dostatečném množství za normálních – fyziologických – podmínek v těle syntézována, se může stát nedostatkovou při patologické metabolické zátěži. Tím se vytvořila další skupina aminokyselin, tzv. potenciálně nepostradatelné aminokyseliny. Tento typ aminokyselin je sice v těle syntézován mnohdy v nadbytku, avšak v mnoha kritických situacích vzniká nedostatek této aminokyseliny, který vede ke zhroucení některých životních funkcí.
Současně s tímto fenoménem se vytvořil další důležitý pohled na aminokyseliny. Ten je definován jako farmakonutriční působení a je základem nové oblasti v klinické výživě – nutriční farmakologii. Zcela pochopitelně, pokud jde o nutriční farmakologii, figurují tam i další látky vzdálené od metabolismu aminokyselin, avšak působící mediátorovým účinkem, který je vzdálen od role nutrientů jako zdroje energie. Aminokyseliny v oblasti nutriční farmakologie působí modulačně buď v nezměněné formě, nebo jako prekurzory intermediárních metabolitů a mediátorů. Tento nový přístup pohledu na klinickou výživu má nyní obecný charakter a zasahuje do širokého pole nutrientů i mimo oblast metabolismu aminokyselin a proteinů.
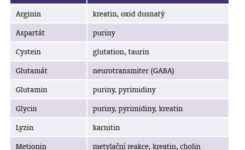
Využití aminokyselin v procesu syntézy metabolitů a mediátorů ukazuje tabulka č. 1.
Metabolismus a funkce jednotlivých aminokyselin
1. Serin
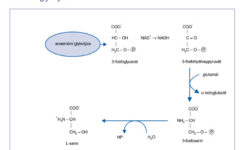
Serin je syntézován z fosforglycerátu, který je intermediárním produktem glykolýzy. Dehydrogenací 3-fosforglycerátu vznikne nejprve alfa-ketoglutarát a 3-fosforserin, který po odštěpení zbytku kyseliny fosforečné poskytne L-serin. Serin je metabolizován na glycin a z tohoto hlediska je důležitý pro syntézu fosfolipidů a cysteinu (obrázek č. 1)
2. Prolin
Prolin vzniká z glutamátu a zpět se může na glutamát metabolizovat. Jeho metabolismus je spojen s metabolismem ornitinu a argininu. Prolin je aminokyselina zásadní důležitosti pro tvorbu kolagenu.
3. Histidin
Histidin je neesenciální aminokyselinou, potenciálně esenciální se jeví u pacientů s renálním selháním. Také je podmíněně esenciální pro vyvíjející se dětský organismus. Štěpením heterocyklické struktury histidinu umožňuje tvorbu N-formiminoglutamátu. Při nedostatku folátů vzniká akumulace formiminoglutamátu. Histidin je prekurzorem histaminu, který je důležitým neurotransmiterem v nervových zakončeních a v mozku. Histamin hraje roli při kontrakci hladkých svalových buněk, zejména střeva a bronchů, vazbou na H1-receptory se uskutečňuje aktivace v alergických reakcích. Při aktivaci H2-receptorů je ovlivněna sekrece kyseliny solné v žaludku. Fyziologickým antagonistou histaminu je adrenalin.
4. Rozvětvené aminokyseliny – valin, leucin, izoleucin
Rozvětvené aminokyseliny jsou esenciální, ale mohou vznikat v intermediárním metabolismu z jejich ketoforem. Leucin je prekurzorem 3-hydroxy-3-metyl-glutaryl-koenzymu A, který jako intermediární metabolit má zásadní důležitost při syntéze izoprenoidů a cholesterolu. Z leucinu vznikající 3-hydroxy-beta-metylbutyrát tím, že zvyšuje dostupnost prekurzorů pro endogenní syntézu cholesterolu, hraje zásadní roli při syntéze buněčných membrán, zejména příčně pruhovaného svalu. V této roli jsou leucin a jeho metabolity důležité pro endogenní syntézu cholesterolu při budování buněčných membrán, zejména buněk příčně pruhovaného svalstva. Tím se uplatňuje leucin a beta-hydroxy-beta-metylbutyrát jako důležitý nutrient při udržení svalové hmoty a v potlačení sarkopenie. Izoleucin a valin se jako prekurzory propionyl-koenzymu A podílejí významně na glukoneogenezi. V pohledu na funkci těchto tří aminokyselin je nutné si uvědomit, že leucin je čistě ketogenní aminokyselina, zatímco izoleucin a valin jsou jak ketogenní, tak glukogenní.
5. Aminokyseliny obsahující síru
Hlavními aminokyselinami, které obsahující síru, jsou metionin a cystein. Metionin je esenciální aminokyselina, zatímco cystein může být syntézován z metioninu, takže klasicky není zařazován mezi aminokyseliny esenciální.
Metionin – má důležitou úlohu v přenosu síry a jako základní přenašeč metylových skupin v biosyntézách v biosyntetických procesech organismu.
Cystein – je prekurzorem a reguluje biosyntézu glutationu. Jeho dostatečný přívod a syntéza z metioninu doplňují zásoby glutationu v játrech, a tím zabraňují toxickému poškození jater, zejména hepatotoxicitě způsobené předávkováním acetoaminofenem. Metabolity acetoaminofenu reagují silně s SH skupinami bílkovin a glutationu, a tím narušují reduko-oxidační rovnováhu. Cystein i cystin se navzájem mění působením enzymu cysteinreduktázy a dalšími látkami, které ovlivňují redukční rovnováhu.
Produkty metabolismu cysteinu u člověka jsou pyruvát, taurin a anorganický sulfát. Cystein chybí v dostatečném množství, nebo úplně ve většině infuzních aminoroztoků pro parenterální výživu. Cystein přechází plynule v cystin podle reduko-oxidačního prostředí, a proto je obtížné, nebo nemožné v měnící se aktuální reduko-oxidační rovnováze stanovit koncentraci jedné z těchto látek, ale jde vždy o sumu cysteinu a cystinu.
Taurin – poměrně dlouho nebyly metabolické funkce a jeho nutričně farmakologický účinek dostatečně prozkoumány. Taurin patří mezi hlavní volné aminokyseliny v centrálním nervovém systému, kde vystupuje v roli neurotransmiteru. Je obsažen v poměrně velkém množství ve tkáni sítnice, ve svalstvu a v plicích. Nové poznatky ukazují velkou důležitost taurinu při stabilizaci membrán, např. při hypoxii myokardu a spouštění arytmií. Taurin se uplatňuje jako stabilizátor buněčných membrán a jeho nízké hladiny se vyvíjejí v katabolismu při rozvoji nádorových onemocnění, pravidelně se projevuje jeho deficit při chemoterapii a ozařování, dále v postagresivním stavu po rozsáhlých operacích, traumatech a popáleninách. V těchto stavech je často potlačena aktivita enzymu, který rozhoduje o rychlosti syntézy taurinu – cysteindekarboxylázy. V protrahovaných kritických stavech se pravidelně vyvíjí deplece taurinu, která souvisí i s deficitem jeho prekurzorů. Transport taurinu intracelulárně přes buněčnou membránu vyžaduje dva kardinální ionty – sodík a chlór. Při depleci těchto iontů vázne transport taurinu intracelulárně, a tím je vážně narušena osmotická regulace buňky. Taurin podle novějších dat potencuje efekt vazby inzulinu na inzulinové receptory, a ovlivňuje tak glykoregulaci. Dostatečný přívod taurinu a jeho zvýšení do farmakologických dávek vede ke snížení plazmatických koncentrací lipidů, zejména u osob s inzulinovou rezistencí, diabetiků a obézních jedinců. Farmakonutriční efekt se projevuje při přívodu taurinu vyšším než 3 g za den. Farmakologické dávky taurinu mají schopnost normalizovat sekreci inzulinu a zlepšit reparace betabuněk Langerhansových ostrůvků poškozených cytokiny. Taurin se uplatňuje v hypotermní ochraně orgánů, a má tak využití v traumatologii a transplantační medicíně. Recentně bylo prokázáno, že suplementace farmakologickými dávkami taurinu, jeho zvýšení v kardioplegických roztocích chrání tkáň myokardu a obecně snižuje ischemicko-reperfuzní poškození. Taurin ochraňuje játra stabilizací rovnováhy antioxidačního systému a aktivních forem kyslíku, zejména při lipoperoxidačních procesech, nejen při lipoperoxidačním inzultu, ale také vlivem toxických účinků, např. při chemickém poškození tamoxifenem, antiestrogenními cytostatiky. Další důležitou funkcí taurinu je neuroprotekce. Taurin, který je strukturně podobný inhibitorům neurotransmiteru kyseliny gama-aminomáselné (GABA), se váže na glycinové receptory a potlačuje toxickou stimulaci neuronů glutamátem. Tím se otevírají nové cesty farmakonutričního působení taurinu v metabolické péči. Pokud jde o suplemetaci taurinem, většina komerčních roztoků aminokyselin pro parenterální výživu obsahuje nedostatečné množství taurinu, nebo v nich taurin zcela chybí. To je způsobeno jeho špatnou rozpustností a nevyvážeností – interferencemi s ostatními aminokyselinami. Výjimku tvoří parenterální formule Neonutrin, které jsou suplementovány cysteinem i taurinem.
6. Fenylalanin a tyrozin
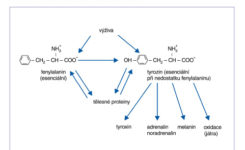
Fenylalanin a tyrozin jsou aminokyseliny, které vytvářejí dvojici, z nich fenylalanin je esenciální a tyrozin je neesenciální, pokud je dostatek fenylalaninu, ze kterého se vytváří hydroxylací. V případě deplece fenylalaninu, nebo při porušení procesu hydroxylázového systému je tyrozin podmíněně esenciální. Obě aminokyseliny jsou důležitými prekurzory pro hormony tyrozin, adrenalin a noradrenalin. Metabolismus fenylalaninu je znázorněn na obrázku č. 2. V aminokyselinových roztocích pro parenterální výživu je tyrozin nestabilní, pokud se překročí jeho koncentrace 0,5 g/l.
7. Tryptofan
Nepostradatelnost tryptofanu a riziko jeho nedostatku je spojeno se skutečností, že je prekurzorem pro syntézu kyseliny nikotinové a jejího amidu. Ten je zásadní pro syntézu NAD a NADP. Dalším důležitým metabolitem s mediátorovým efektem, který vzniká z tryptofanu, je 5-hydroxytryptamin (serotonin). Tento mediátor je významným vazokonstriktorem, stimuluje kontrakci hladkých svalů a v mozku působí jako neurotransmiter a v epifýze jako prekurzor v biosyntéze melatoninu.
8. Arginin
Arginin se tvoří v ledvinách, játrech a mozku, kde však nevzniká z ornitinu, protože tyto orgány vykazují nízkou aktivitu enzymu, který konvertuje ornitin na citrulin. V těle je jinak produkován v cyklu močoviny z ornitinu, avšak ihned po svém vzniku je vlivem vysoké aktivity enzymu arginázy rozštěpen. Glutamin zachycený ve střevě je rychle metabolizován na citrulin a uvolněn do oběhu. Z krevního oběhu je citrulin vychytáván v ledvinách a metabolizován na arginin. Metabolicky slouží arginin v přenosu aminodusíku mezi orgány, a proto z hlediska nutriční farmakologie se formule aminoroztoků bohaté na arginin doporučují pro těžké katabolické stavy a umělou výživu po těžkých úrazech. Arginin je výrazný stimulátor vylučování somatotropního hormonu a inzulinu, a tím stimuluje anabolické procesy. Arginin je zdrojem oxidu dusnatého, zejména v endoteliálních buňkách, makrofázích, neutrofilech a nervových buňkách. Produkce oxidu dusnatého oxidativní cestou vzniká jako odpověď na vliv endotoxinu a cytokinů. Oxid dusnatý má mediátorové účinky – vazodilatační efekt – a inhibuje růst virů, bakterií a nádorových buněk. Oxidu dusnatému se přičítá hypotenzivní efekt vyvolaný uvolněním entodotoxinu. Arginin je, jak vyplývá z uvedených účinků, aminokyselinou vhodnou pro stimulaci anabolických stavů a v posttraumatické péči, negativním efektem však je přestřelená reakce s nadměrnou tvorbou oxidu dusnatého v sepsi, která svým prooxidačním a vazodilatačním účinkem může zhoršit stav pacienta s rozvojem septického šoku. Dalším negativním efektem argininu je kompetice excesivních množství argininu s lyzinem, jehož reabsorpci v ledvinných tubulech snižuje, a tak zvyšuje ztráty, a tím může vyvolat depleci esenciální aminokyseliny lyzinu. Podání L-argininu ve farmakologických dávkách inhibuje agregaci destiček a endoteliální dysfunkci. Při nedostatku argininu se nevytváří dostatečná antiinflamatorní reakce, jednak deficitem oxidu dusnatého, jednak účinky na funkci makrofágů, granulocytů a reakcí tkání na inflamatorní proces. Při nedostatku argininu se projevují důsledky ve snížené tvorbě hnisu, defektním vytváření protiinflamatorních bariér v oblasti peritonea a pleury, nedochází ke ztluštění těchto struktur v případě zánětu a celkový obraz dělá dojem snížené reakce na infekci podobné jako při vysokých dávkách kortikoidů. Výsledkem deficitu argininu, který je sice neesenciální aminokyselinou, ale jehož nedostatek se projeví při nadměrné spotřebě v kritickém stavu, je nedostatečná antiinflamatorní odezva, což vede k fatálnímu zakončení bez bouřlivé zánětlivé reakce.
9. Kyselina glutamová (glutamát) a glutamin
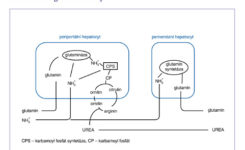
Role kyseliny glutamové a glutaminu je velmi důležitá z několika důvodů – jako zdroj energie, aminokyselina pro výstavbu proteinů a jako prekurzor mediátorů v nervovém systému. Glutamin je prakticky nejčastější aminokyselina v bílkovinách živočišného organismu. Metabolismus kyseliny glutamové a glutaminu závisí na dvou enzymech – glutamin-syntetáze a glutamináze. Glutamin-syntetáza je zodpovědná za syntézu glutaminu, zatímco glutamináza odštěpuje z glutaminu amonný iont a podílí se na tvorbě glutamátu. Tyto enzymy nejsou obvykle současně v jedné tkáni, takže v tkáních, kde převažuje glutamin-syntetáza, se glutamin vytváří a v tkáních, kde převažuje glutamináza, se vytváří glutamát z glutaminu (obrázek č. 3).
Mezi tkáně obsahující vysokou aktivitu glutaminázy patří lymfocyty, tenké střevo a ledviny. Typickou tkání, která glutamin produkuje a má vysokou hladinu glutamin-syntetázy, je svalstvo. Svalová tkáň a plíce navíc obsahují velkou zásobu glutaminu, který je v případě nutnosti uvolnitelný do oběhu. Výjimku z těchto pravidel tvoří játra, která obsahují jak glutaminázu, tak glutamin-syntetázu, ale v různých strukturách jater. Glutamin a alanin jsou nejčastější složkou většiny tkáňových bílkovin a ve svalstvu představují více než 50 % aminokyselin, které se uvolňují ze svalu. Glutamin je z tohoto hlediska aminokyselinou neesenciální, která je sice v organismu v mimořádném nadbytku, avšak v kritických stavech je jeho spotřeba na tvorbu energie, reparaci tkání a hojení tak vysoká, že se staví do role potenciálně esenciální aminokyseliny a pokud není v nutričním systému suplementována, dochází k poruchám v imunologické odezvě, zhroucení střevní bariéry, zpomalení reparačních projevů v poškozených orgánech a k defektnímu hojení. V zátěžovém stavu, zejména u kritických pacientů, může být přes vysokou produkci glutaminu v organismu jeho spotřeba pro dělící se buňky tak vysoká, že je nutné ji intenzivně suplementovat umělou výživou.
Glutamát je v novější době někdy doporučován jako náhrada glutaminu do formulí aminoroztoků. Glutamin má nevýhodu v tom, že je nestabilní a špatně rozpustný, takže dosáhnout v roztocích pro parenterální výživu jeho dostatečné množství je technologicky obtížné. Glutamát je sice z tohoto hlediska výhodnější, avšak velmi obtížně vstupuje do buněk a jeho účinek v parenterální výživě je tedy tímto mechanismem limitován. Pokud jde o toxicitu glutamátu, je velmi nízká při enterálním podání, ale jeho negativní účinky jako neurotransmiteru s případným toxickým efektem se mohou projevit u pacientů v akutním nebo kritickém stavu. Dávky glutamátu kolem 15 g/den u osob s tělesnou hmotností 70 kg však zůstávají bezpečné a jeví se jako užitečné pro zlepšení proteinového metabolismu.
Neočekávanou roli zaujímá podle posledních studií glutamin jako regulátor HSP (heat shock protein). HSP proteiny jsou skupinou vysoce stabilních proteinů, které se významně podílejí na mechanismech buněčné ochrany. Exprese těchto proteinů stoupá u subletálních poškození a indikuje tzv. stresovou toleranci. Heat shock proteiny, jejichž exprese ve stresu prudce stoupá, umožňují přežití subletálních poškození a specificky hrají roli při sepsi, akutním plicním distresu dospělých (ARDS), při těžkých nekrotických poškození orgánů, hluboké ischemii a reperfuzi a dalších život ohrožujících stavech, jako je popáleninové trauma, případně podchlazení. Heat shock proteiny prokazatelně potlačují účinek proinflamatorních cytokinů a jejich přestřelenou reakci, zvýšení HSP-70 snižuje mortalitu pacientů po rozsáhlém traumatu. HSP působí jako tzv. „chaperones“. Což můžeme chápat jako funkci strážců a ochránců proteinů před poškozením. Jejich ochranná role v oblasti funkčních proteinů je široká a zahrnuje ochranu prostorové terciární struktury, jejich ochranu a bezpečný transport nově syntezovaných proteinů z místa syntézy do místa působení a blokování nefunkčních proteinů. Glutamin je prvním klinicky prokazatelně farmakologickým regulátorem exprese HSP. Tím mohou být vysvětleny mnohé vlastnosti glutaminu při regeneraci poškozené střevní stěny či kostní dřeně a jeho příznivý účinek při sepsi, septickém šoku i reakci na popálení, podchlazení a trauma.
Závěr
Při hladovění a při katabolismu dochází k nerovnoměrnému a zvýšenému spotřebování aminokyselin jako náhradního energetického substrátu za tuk a při rozvoji glukózové intolerance a omezení přívodu cukru jsou aminokyseliny nezbytným zdrojem energie a prekurzorů pro glukoneogenezi. Náhradním zdrojem energie i pro nejtěžší stavy katabolismu a stresu kritického pacienta jsou rozvětvené aminokyseliny valin, leucin a izoleucin, které poskytují ketolátky využitelné ubikvitárně ve všech tkáních i při nedostatku glukózy. V podobných stavech je zdrojem energie glutamin, který po deaminaci poskytuje kyselinu alfa-ketoglutarovou, rovněž důležitý anaplerotický substrát v energetickém deficitu. Při zátěži, např. po rozsáhlé operaci, případně polytraumatu, dochází k poklesu některých aminokyselin, zejména glycinu, histidinu, asparaginu a taurinu. Ukazatelem závažnosti katabolismu je také využitelná změna fenylalaninu, který se zvyšuje až 1,5násobně. Typickým projevem kritického stavu je zvýšení poměru fenylalanin/tyrozin. Zásadně je však třeba respektovat skutečnost, že plazmatické hladiny aminokyselin jsou výsledkem více faktorů, jako jsou rychlost uvolňování z tkání, dostupnost v zásobách, aktivita syntézy (pokud jde o aminokyseliny neesenciální), rychlosti jejich utilizace a případně rychlosti jejich vylučování. Z toho tedy vyplývá, že cílem umělé výživy, pokud jde o aminokyseliny, není normalizace aminogramu v plazmě. Přívod aminokyselin a jejich optimální složení ve formuli je pouze jednou z podmínek dosažení dusíkové rovnováhy, nebo zlepšení negativní dusíkové bilance, avšak dostupnost aminokyselin v jednotlivých metabolických oblastech je limitována současným stavem katabolismu a anabolismu v organismu, a plazmatický aminogram je tedy jen hrubě orientační ukazatel metabolismu aminokyselin.
MUDr. Róbert Hromádka
C2P s.r.o., Chlumec nad Cidlinou
MUDr. Radomír Hyšpler, Ph.D.
Fakultní nemocnice Hradec Králové
RNDr. Alena Tichá, Ph.D.
Fakultní nemocnice Hradec Králové
prof. MUDr. Zdeněk Zadák, CSc.
Fakultní nemocnice Hradec Králové
e-mail: zadak@fnhk.cz